
在2023年美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(ASCO-GU23)上,慧渡医疗与美国Moffitt癌症中心合作开展的研究成果获得杰出贡献奖(Merit Award)并入选大会 “最新突破摘要” (Abstract #LBA445)。该研究表明尿液游离DNA(utDNA)可用于预测高危非肌层浸润性膀胱癌(NMIBC)首次手术后的微小残留病灶MRD状态。

微小残留病灶(minimal Residual Disease,MRD)作为新的标志物,在早期实体瘤术后动态监测及复发风险预测中的巨大应用潜力已成为业内共识。与组织和外周血样本相比,尿液更易获取,可以真正实现无创检测。美国Moffitt 癌症中心与慧渡医疗合作评估了utDNA用于预测高危NMIBC患者首次TURBT术后的MRD状态的性能表现。
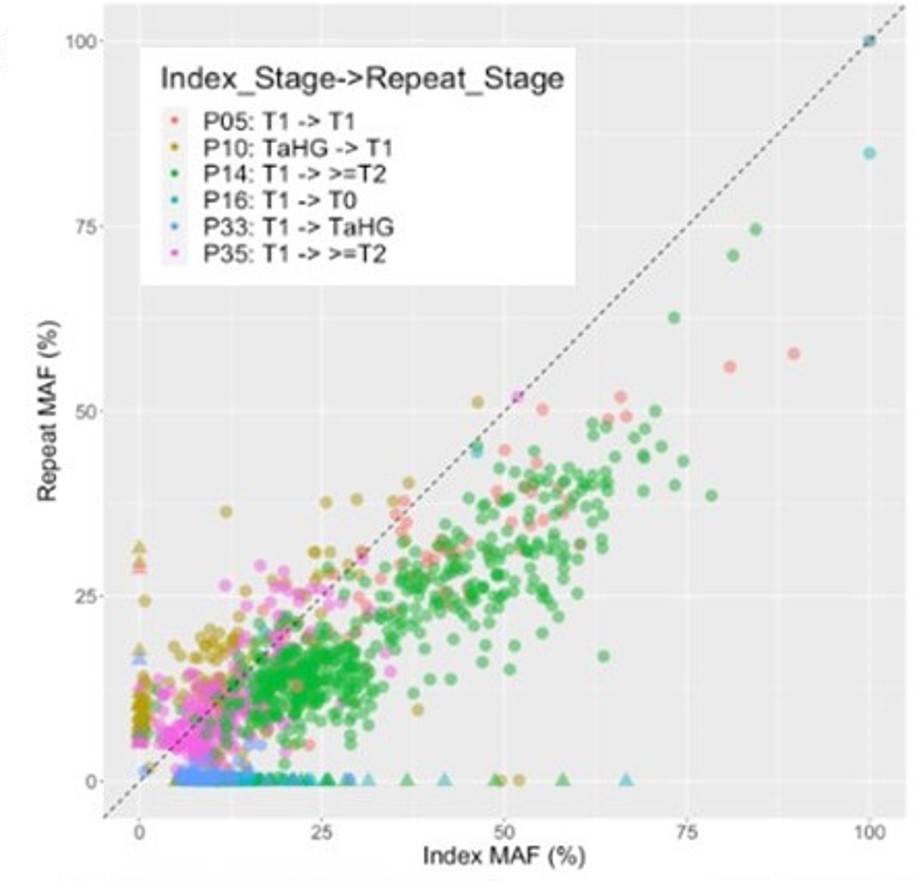
该研究纳入了11例接受重复TURBT(rTURBT)手术的高危NMIBC患者。使用慧渡医疗全外显子测序产品PredicineWES+™分别检测患者首次手术和再次TURBT手术(rTURBT)时的样本中的基因突变。同时采集患者再次手术前的尿液样本,以首次手术样本检测结果为基线,使用慧渡医疗超深度MRD检测产品PredicineBEACON™检测尿液样本中的肿瘤突变,并依据自主开发的生信算法计算rTURBT前的MRD状态。
研究结果表明:约73%患者的rTURBT样本中存在肿瘤残留,并且与首次基线样本的突变高度一致(83%)。在尿液样本中,最常发生突变的基因依次是TP53、PIK3CA、RB1、MYC、CDKN1A和ARID1A。首次手术后MRD阳性患者的尿液中,肿瘤含量更高。当肿瘤含量>=3.3%时,PredicineBEACON™的敏感性和特异性分别为75%和100%。本次报道的研究成果表明利用utDNA可以用于预测高危NMIBC患者首次TURBT术后的MRD状态,为这类患者进一步的干预决策提供诊断依据。
慧渡医疗与全球前十名的国际药企进行临床合作研究,多篇文章发表在THE LANCET Gastroenterology & Hepatology等影响因子达45分的国际顶级学术期刊。慧渡医疗新一代液态活检技术灵敏度高、样本要求量低,获得国际最权威的美国FDA突破性医疗器械认定(点击查看原文)、欧盟CE认证和英国UKCA认证(点击查看原文),这是国际权威监管机构对慧渡医疗技术、产品和其临床应用价值的认可和背书。
